Enzimas são proteínas especializadas que aumentam a velocidade das relações químicas.
Possuem estrutura tridimensional definida: 3ª ou 4ª.
Representação esquemática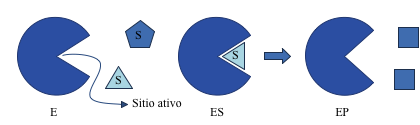
- A) Sitio ativo – local de ligação do substrato.
- B) Reação catalítica – reação de quebra, degradação (digestão)
- C) Lise – lipólise – quebra de gordura
Reação anabólica
São reações de síntese (formação)
Gênese lipogênese = formação de gordura
Substrato
“Alvo” da enzima. Moléculas ou substâncias que as enzimas atuam sobre.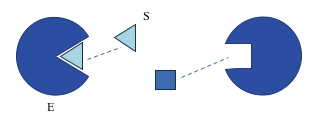
- Especifica para cada enzima.
Enzimologia
Sitio ativo
| Enzima | Substrato |
| Lipase | Lipídeos |
| Protease | Proteínas |
| Insulinase | Insulina |
| Amilase | Amido |
- Enzimas podem ser inibidas (bloqueada);
- ATB (antibióticos) – são os principais exemplos de inibidores enzimáticos.
Inibição enzimática
Inibidor enzima reversível 1 – I. E. R competitiva
1 – I. E. R competitiva
- Existe competição entre o substrato e o inibidor no sitio ativo;
- O inibidor para e não tem reação.
2 – I.E.R não competitiva
- Não existe competição porque existe 2 ou mais sítios ativos.
Inibidor enzima irreversível
- O sitio ativo da enzima é bloqueado de maneira definitiva.
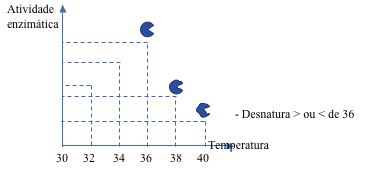
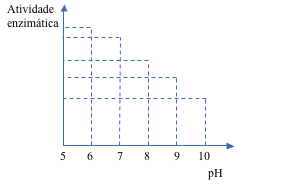
– Enzimas podem ser desnaturadas
pH / Temperatura / Metais pesados / Agitação mecânica
Enzimas podem ser usadas para diagnosticar doenças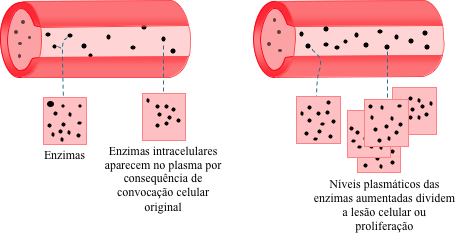
| Enzima | Serve p/ diagnostico |
| Fosfatase Alcalina | Doenças ósseas |
| CKMB | Infarto do miocárdio |
| LDH | Infarto do miocárdio Hepatite |
| TGO / TGP | Doenças hepáticas |
| Fosfatase Acida | Câncer de próstata |
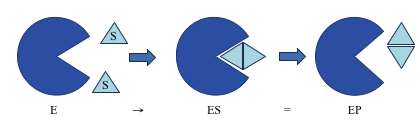
Enzimas aumentam a velocidade das reações químicas, mas não afetam o equilíbrio das reações.
E+S > ES = E + P
Cinética das enzimas
- Toda enzima precisa de temperatura e pH ótimos para trabalhar;
- Alterações drásticas de pH e/ou temperatura podem desnaturá-las.
São reguladas por fatores que podem:
1 – Ativar enzima
2 – Inibir a enzima
*Possuem mais do que um sitio de ligação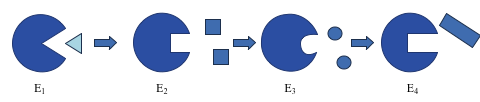
Conteúdo retirado e baseado da aula do Prof. João Armando Brancher, Universidade Positivo
Contribuição: Leonardo Martins Sant’Anna