pH – Potencial de hidrogênio
É a escala que mede a concentração de ácido em determinadas soluções. Indica-se a solução básica ou neutra.
Ácidos – Substâncias químicas que quando colocadas em H2O liberam H+ (prótons).
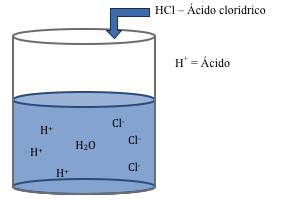
Bases – Substâncias químicas que quando colocadas em H2O liberam OH– hidroxila.
pH da água pura
Mais importante que tudo:
- [H+] – : pH mais ácido, menor o pH;
- ¯ [H+] : pH menos ácido, maior o pH;
- H+ = OH– : pH é = 7,0 (neutro);
- H+ > OH– : pH é < 7,0 (ácido);
- H+ < OH– : pH é > 7,0 (básico).
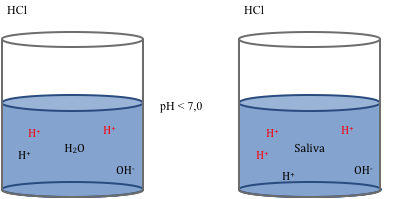
pH de soluções fisiológicas
pH da saliva: (6,5 – 7,5) > 7,0.
(quando a boca da pessoa for saudável).
Quando o pH bucal for menor que 5,5 eles desmineralizam.
pH < 5,5 – desmineralização
- Carie dentária;
- Erosão dentária.
pH > 8,0 – calculo dentário (aglomeração de mineral)
- Doença periodontal
pH do sangue
7,35 – 7,45 (7,40)
OH– > H+
pH menor que o normal = acidose = pH : 6,8 = óbito
Ex.: Diabetes, PCR (Parada cardio respiratória), exercícios físicos, hábitos alimentares entre outros.
pH maior que o normal = alcalose = pH > 8 = óbito
Ex.: Vômitos recorrentes, infecções.
pH da urina
4,0 – 8,0 (6,0)
O pH da urina reflete o pH do sangue
Eliminação do H+
Reabsorção de OH–
Obs.: Insuficiência renal > desequilíbrio ácido e básico do sangue
Tampão
São substâncias que capturam pequenas quantidades de ácidos (H+) ou bases (OH–) estabilizando o pH.
Ex.:
– HCO3– (bicarbonato);
– HPO4– (fosfato);
HCO3– + H+ > H2O + CO2
Obs.: O tampão bicarbonato é o principal tampão do sangue.
Regulação do equilíbrio acido básico
Qual a importância de manter o pH do corpo estável?
Qualquer desequilíbrio pode ocasionar acidose ou alcalose. Esses desequilíbrios podem afetar o metabolismo celular.
Quais são as linhas de defesa contra as mudanças de pH?
1° Tampões
- Substâncias que capturam (H+) ou (OH–) estabilizando pH;
- São a linha de defesa mais rápida.
- – Bicarbonato (HCO3–) (mais importante)
Como ele funciona quando há acidose?
HCO3– + H+ = H2CO3 = CO2 + H2O
Obs.: O que ocorre se a pessoa tiver parada respiratória?
Concentração de CO2 que reage com agua, aumentando a concentração de H+.
- – Fosfato (HPO4)
- Importante para controlar eventos de alcalose
mais ¯H+, mais pH, mais OH–
HPO4-2 + OH– > HOH + PO4-3
1.3 – Proteína (hemoglobina) – menor Hb = anemia
- Hb é encontrada nos glóbulos vermelhos. Sua função é transportar oxigênio dos pulmões para as celas;
- Hb também é um tampão
CO2 é produzido no Metabolismo celular – células
(Resíduo do organismo)
2° Pulmões
- 2° linha de defesa;
- São responsáveis pelas trocas gasosas (CO2 – O2);
Como funciona quando existe acidose?
HCO3– + H+ > H2CO3 > ^ CO2 + H2O
Taquipnéia = maior F.R.
Como funciona o pulmão em alcalose?
maior pH, maior OH– , menor ¯H+
HCO3– + H+ > H2CO3 = CO2 + H2O
menor F.R = Bradipnéia > reter CO2 para repor H+
Acidose = joga fora (Taquepineia)
Alcalose = absorve (Bradipnéia)
3° Rins
- 3° Linha de defesa;
- Mais lenta porém eficaz;
- Néfron: Unidade filtradora do rin
A – Filtração glomerular: remoção de impurezas do sangue;
B – Reabsorção tubular: “devolve” para o sangue;
C – Secreção tubular: remoção de resíduos do sangue.
| Rins | Acidose | Alcalose |
| Filtram | H+ | OH– |
| Reabsorvem | OH–/HCO3– | H+ |
| Secretam | H+ | OH– |
Resumo baseado na aula do Prof. João Armando Brancher
Contribuição: Leonardo Martins Sant’Anna




